- TOP
- 治療する
治療する
肺MAC症の治療は?
- 肺NTM症で最も多い肺MAC症の治療は、抗菌薬による薬物療法が中心ですが、現時点では決定的な治療薬はないと考えられています1)。
- 治療開始時期は、患者の年齢、症状、副作用のリスクなどを考慮して、総合的に判断します1)。
- 治療は、空洞のない結節・気管支拡張型(重症は除く)、重症例、難治例で異なり、治療期間はいずれも培養陰性化が達成されてから最低1年間継続とされています2)。
- マクロライドの耐性化を抑止することは重要で、マクロライド単剤治療、マクロライドとキノロンやリファンピシンなど、エタンブトールを含まないレジメンでの治療を避けるようにとされています2)。
- 主病巣が明らかで、かつ化学療法を行っても菌が陰性化しない症例などでは、外科治療(肺切除術)を行う場合もあります1)。
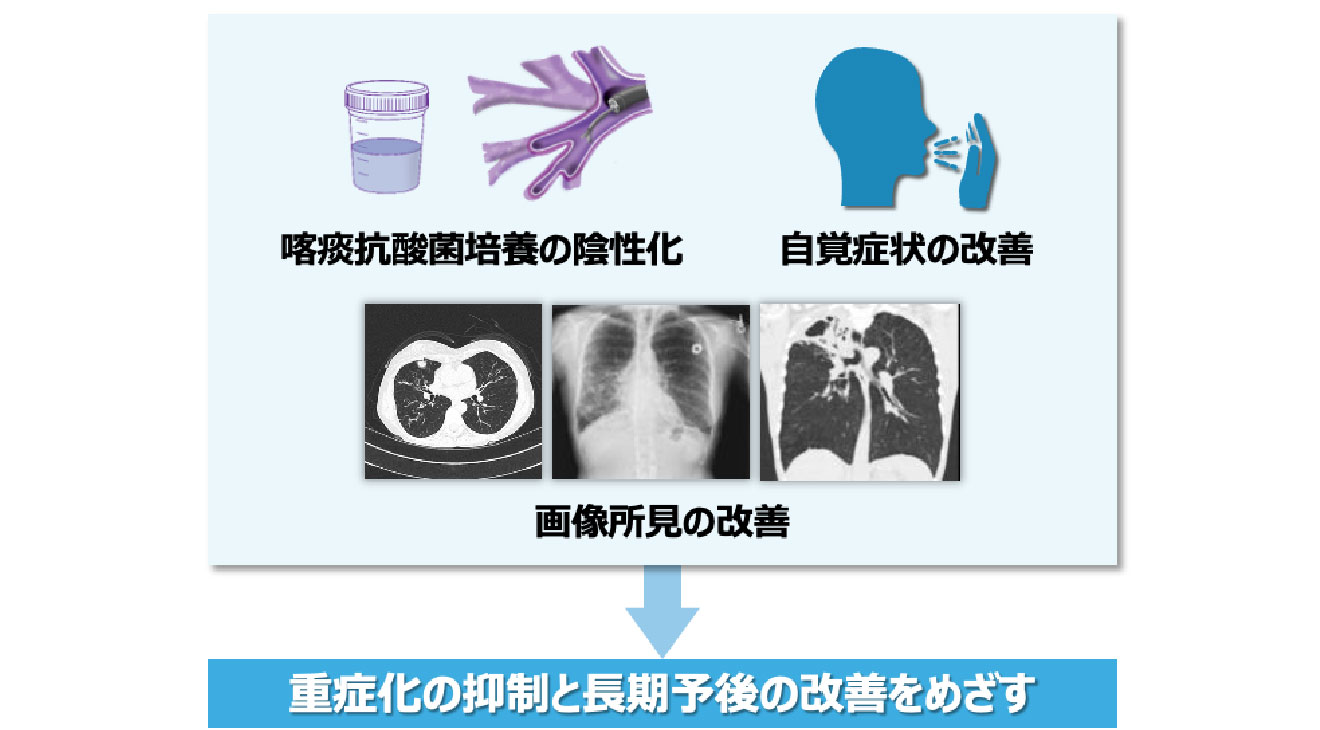
治療目標
自覚症状の改善と重症化抑制による
長期予後の改善をめざします
治療開始のタイミング
治療開始時期は総合的に判断します
治療のリスクとベネフィット
- 肺MAC症は、確定診断がついてもすぐに治療を開始するとは限りません。無治療でも進行が緩徐なこともあるため、治療した場合の副作用を考慮し、経過観察を行う場合があります 表1 。
肺MAC症治療開始における
リスク-ベネフィット
- 治療するメリット
- 自覚症状の改善
- 長期予後の改善
- 治療しない場合のリスク
- 進行悪化する
- 手術の機会を逸する
- 重症化してからでは
治療で改善しにくい - 治療する場合のリスク
- 副作用
- 併用薬の相互作用
- 薬剤耐性の誘導
- コスト
中川拓, 小川賢二. 呼吸器ジャーナル. 2018; 66(4): 608-615. より改変
治療開始時期の考え方
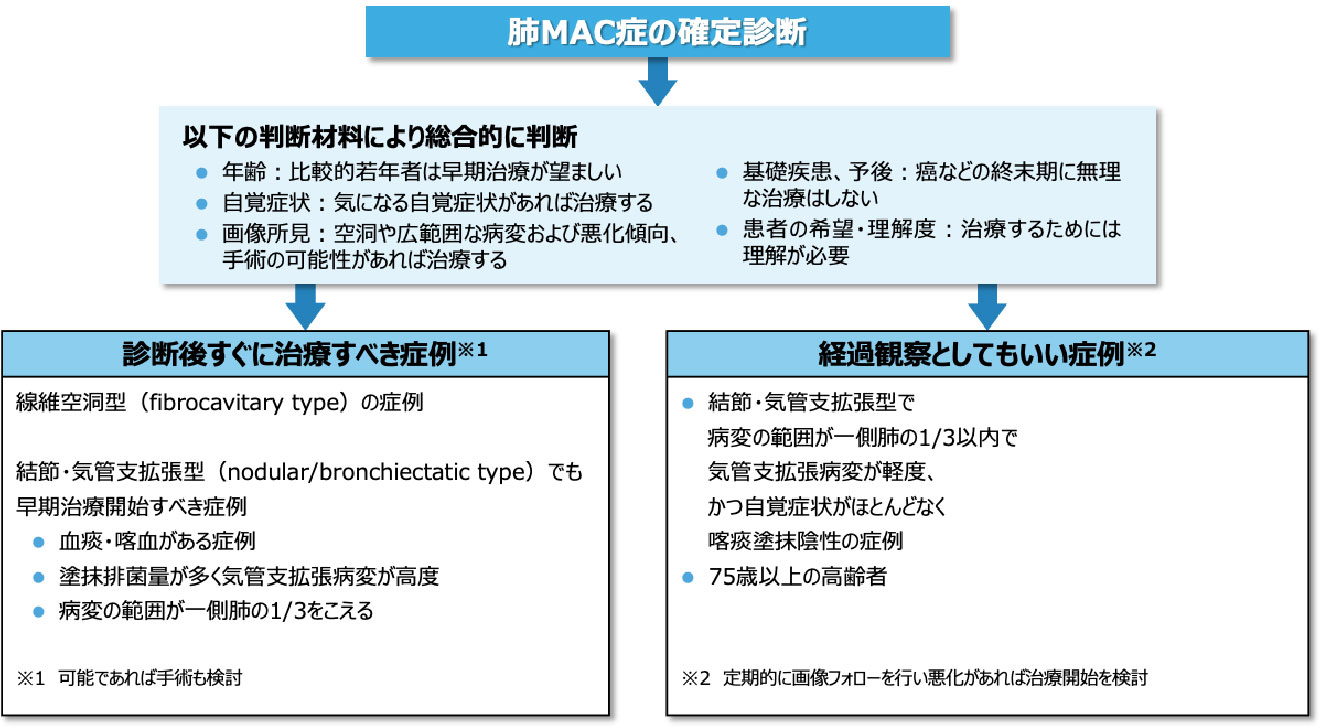
- 診断の確定は治療開始のための必要条件ではありますが、それが必ずしも直ちに治療を開始する十分条件ではありません2)。
- 治療開始時期は、患者ごとに年齢や自覚症状、画像所見、基礎疾患、患者の希望などを考慮して、総合的に判断します 図2 1)。
- 喀痰塗抹陰性や排菌量の少ない症例、無症状例、空洞を認めない結節・気管支拡張型の軽症例では、治療開始時期については注意深い観察を前提として個別に検討します2)。
- ATS/ERS/ESCMID/IDSAガイドライン2020では、喀痰抗酸菌塗抹陽性あるいは有空洞例には注意深い経過観察(watchful waiting)よりも治療を開始することを推奨しています4)。
- 喀痰塗抹陽性や空洞がある場合は治療を開始するという方針に加えて、年齢によらず忍容性、基礎疾患、画像所見の推移、菌種などを加味して治療の要否を判断します2)。
無治療経過観察の場合
- 無治療経過観察を行うと、10年ぐらい進行しない場合や、自然に菌が陰性化する場合もありますが、1〜2年で急速に悪化する場合もあります1, 3)。海外の報告では、無治療経過観察を行った肺MAC症患者の約半数が2〜3年のうちに悪化し、治療開始を必要としました5-7)。
- 治療開始のタイミングを逸しないため、十分に経過観察を行うことが重要です。
肺MAC症の標準治療
標準治療は3剤併用療法を基本とし、
病型によって他の薬剤が追加されます
肺MAC症の治療
- 肺MAC症の治療レジメンは、空洞のない結節・気管支拡張型(重症は除く)、重症例、難治例で異なります表2 2)。
- 空洞がなく、重度の気管支拡張所見がない結節・気管支拡張型には、マクロライド、エタンブトール、リファンピシン(3剤併用療法)を連日投与または週3日の間欠投与で行います2)。
- マクロライドとしては、クラリスロマイシンの他、アジスロマイシンも選択肢となります2)。
- エタンブトールの投与量については、連日投与の場合は15mg/kgを超えないようにします2)。
- 線維空洞型、空洞があるまたは重度の結節・気管支拡張型には、3剤併用療法の連日投与にアミノグリコシド注射薬を追加(併用期間:3~6ヵ月)します2)。
- 標準治療を6ヵ月以上行っても排菌が陰性化しない難治例には、3剤併用療法の連日投与にアミノグリコシド注射薬あるいは、アミカシンリポソーム吸入用懸濁液(ALIS)を追加します2)。
- 重症例、難治例には必要に応じて外科治療の併用が検討されます2)。
肺MAC症の治療
| 病 型 | 治療レジメン | |
| ●空洞のない結節・気管支拡張型(重症は除く) | A法かB法のいずれかを用いる |
|
|
A法:連日投与 CAM 800mg or AZM 250mg EB 10~15mg/kg(750mgまで) *RFP 10mg/kg(600mgまで) |
B法:週3日投与 CAM 1000mg or AZM 500mg EB 20~25mg/kg(1000mgまで) *RFP (600mg) |
|
|
●線維空洞型 ●空洞のある結節・気管支拡張型 ●重度の結節・気管支拡張型 |
A法+治療初期(3~6ヵ月)に以下を併用する ●SM 15mg/kg以下(1000mgまで)週2~3回筋注 あるいは
●AMK 15mg/kg連日 or 15~25mg/kg週3回点滴、TDMで調節 必要に応じて外科治療の併用を検討 |
|
|
●難治例(多剤併用療法を6ヵ月以上実施しても細菌学的効果が不十分な患者) |
A法に以下のいずれかを併用する ●ALIS 590mg/日吸入 あるいは ●SM15mg/kg以下(1000mgまで)週2~3回筋注 あるいは
●AMK 15mg/kg連日 or 15~25mg/kg週3回点滴、TDMで調節 必要に応じて外科治療の併用を検討 |
|
* RFP忍容性の低い症例、薬剤相互作用を懸念する症例ではRFPを減量、さらに除くことも検討する(付記のRFPの項を参照)。RFPを除いた場合にはCAMの血中濃度が低下しないので、低体重の患者ではCAMの減量(400~600mg)を考慮する。AZMを使用する場合には用量調節は必要ない。週3回投与では、基本的に3剤併用が望ましいが、忍容性が低いと判断した場合には、 RFPの減量(300mg~450mg)を考慮する。
CAM:クラリスロマイシン、AZM:アジスロマイシン、 EB:エタンブトール、RFP:リファンピシン、SM:ストレプトマイシン、
AMK:注射用アミカシン、TDM:Therapeutic Drug Monitoring、ALIS:アミカシンリポソーム吸入用懸濁液
日本結核・非結核性抗酸菌症学会 非結核性抗酸菌症対策委員会, 日本呼吸器学会 感染症・結核学術部会. 結核. 2023; 98(5): 1-11.
副作用への対策
- 肺MAC症は高齢者や栄養不良の患者も多く、副作用への対策が非常に重要です。
- 個々の副作用については、日本結核病学会の「結核診療ガイド」8)や厚生労働省の重篤副作用疾患別対応マニュアル9)なども参考として、適切に対処を行います。
- また、薬物相互作用にも注意が必要です。治療開始時には合併症に対する使用薬剤を調べ、薬物相互作用による副作用を回避します1)。
- 副作用が生じた場合は安易に治療を中断終了せず、アレルギーに対する減感作療法や原因薬剤の特定、代替薬の検討などにより、できるだけ治療を再開・継続することが重症化の予防につながると考えられます1)。
治療上の注意
マクロライドは
必ず他の治療薬と併用します
マクロライド耐性化の抑止と
マクロライド耐性への対応
- マクロライド(クラリスロマイシンあるいはアジスロマイシン)は肺MAC症治療のキードラックですが、単剤投与やエタンブトールを併用しないレジメンでの治療を避けるようにとされています 表3 2)。
「成人肺非結核性抗酸菌症化学療法に
関する見解ー2023年改訂ー」
マクロライド耐性に関する記載
| マクロライド 耐性化の抑止 |
キードラッグであるマクロライド(CAMあるいはAZM)の耐性化を抑止することが重要であり、マクロライド単剤治療、マクロライドとキノロンやRFPなどEBを含まないレジメンでの治療を避ける。 |
| マクロライド 耐性の場合 |
EB、RFPあるいはRBTにアミノグリコシド(AMK点滴、SM筋注、難治例であればALIS)を併用する。CFZやシタフロキサシン(STFX)の使用も考慮されるが保険適用はない。 |
CAM:クラリスロマイシン、AZM:アジスロマイシン、RFP:リファンピシン、EB:エタンブトール、RBT:リファブチン、
AMK:注射用アミカシン、SM:ストレプトマイシン、ALIS:アミカシンリポソーム吸入用懸濁液、CFZ:クロファジミン
日本結核・非結核性抗酸菌症学会 非結核性抗酸菌症対策委員会, 日本呼吸器学会 感染症・結核学術部会. 結核. 2023; 98(5): 1-11.
マクロライド耐性例の治療アウトカム
- マクロライド耐性の肺MAC症は予後不良であることが知られています。
- 海外の報告10)では、マクロライド耐性の肺MAC症患者34例を後ろ向きに調査したところ、良好な治療アウトカムが得られた患者は5例(15%)で、その他の85%の患者は不良な治療アウトカムでした。さらに、耐性診断後の5年死亡率は47%でした 図3 。
マクロライド耐性肺MAC症患者の
治療アウトカム(海外データ)
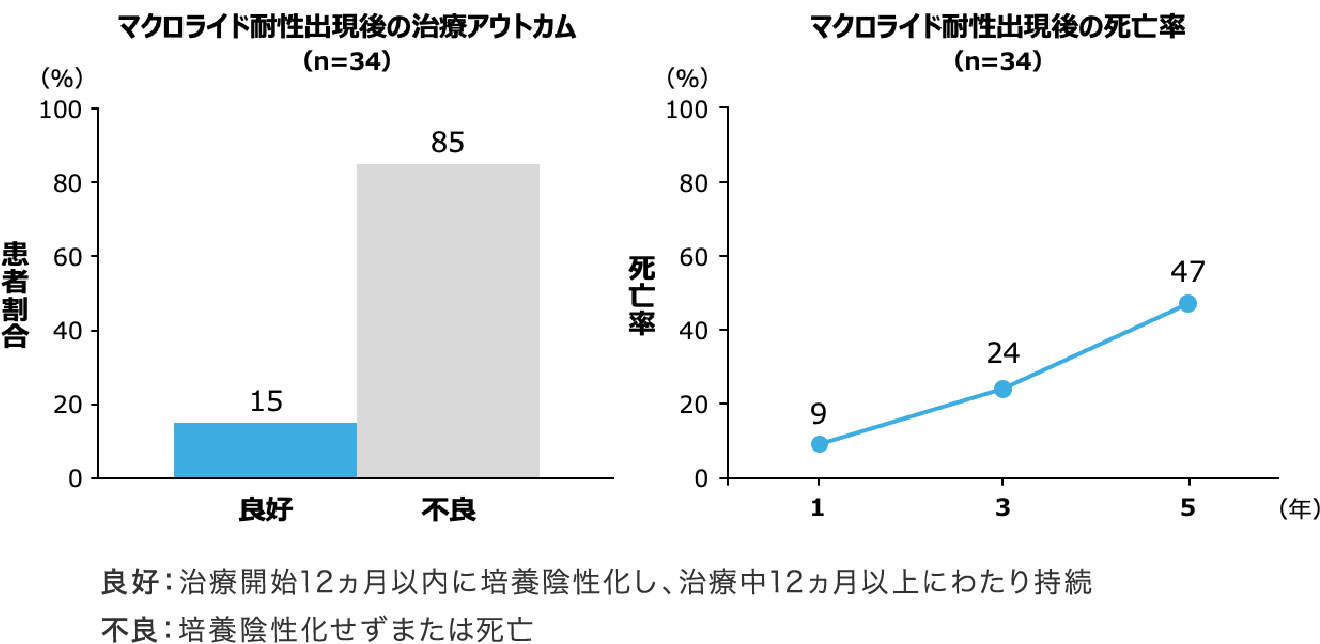
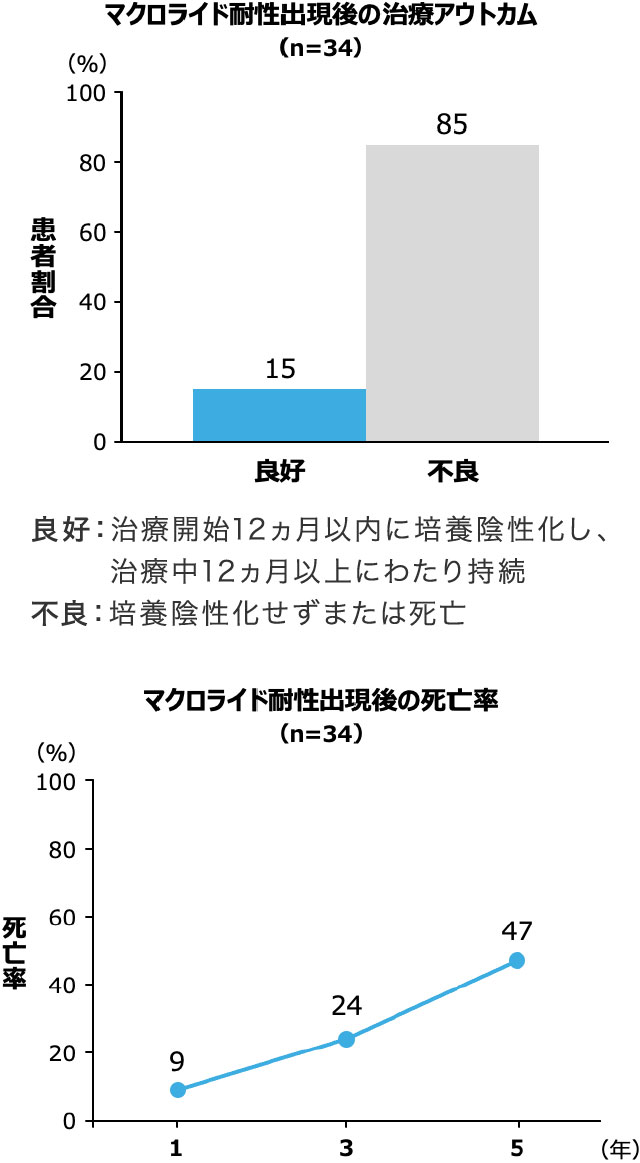
対象・方法:2002〜2014年にソウルの大規模総合病院でマクロライド耐性肺MAC症と診断された34例の診療記録を後ろ向きに調査し、臨床的特性や治療アウトカムを評価した。
Moon SM,
et al. Antimicrob Agents Chemother. 2016; 60(11): 6758-6765. より作成
- 肺MAC症治療では副作用のため3剤併用が難しい場合もありますが、副作用が発現した場合でも原因薬剤を特定し、使用可能な薬剤を2剤以上用いて治療を継続することが大切です1)。
治療効果の評価
治療効果は
培養検査により評価します
- 自覚症状や画像所見の改善が治療反応の評価に有用ではありますが、原則的に喀痰培養検査により治療効果が判断されます2)。
- 治療開始後6ヵ月以上経過しても菌が陰性化しない場合は、 表4 の項目を確認し、外科治療適応などの治療方針を検討します3)。
治療開始後6ヵ月以上経過しても
菌陰性化しない場合のチェック項目
-
治療薬の投与量は適切か
-
服薬コンプライアンスに問題がないか
-
クラリスロマイシン耐性化していないか
中川拓, 小川賢二. 呼吸器ジャーナル. 2018; 66(4): 608-615. より作成
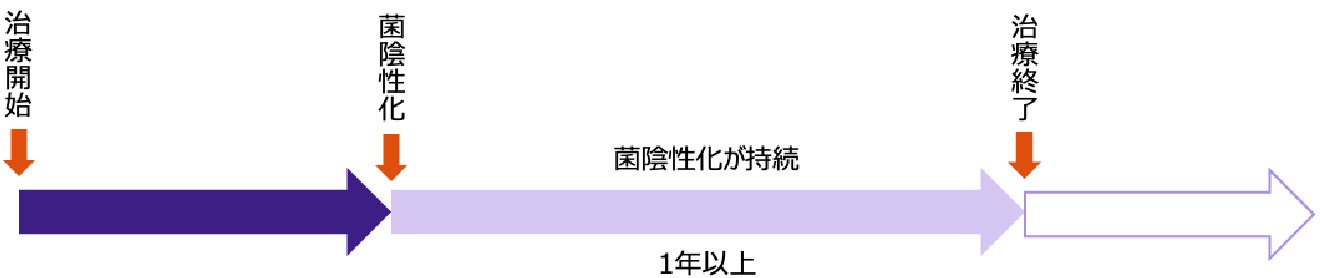
治療期間
培養陰性化後も
一定期間、治療を継続します
- 肺MAC症は、治療により菌が陰性化してもしばしば再発します。再発には、病変に残存していた菌が再び増殖して起こる再燃の場合と、環境中の別の菌に新たに感染して起こる再感染の場合があります。
- 肺MAC症では、再燃のリスクを低減させるため、治療により菌が陰性化しても一定期間、治療を継続します。
- ATS/ERS/ESCMID/IDSAガイドライン2020では、培養陰性化後少なくとも12ヵ月間の治療を受けることが提案されています4)。
- しかし、1年という期間には明確なエビデンスがありません。より長期の方が再発率を低下させる可能性も考えられており1)、適切な治療期間は今後の課題となっています。
経過観察
治療後の再発がまれではなく
経過観察が重要です
- 肺MAC症では、治療により菌が陰性化しても、再発する例がまれではありません。
- 海外では、治療を完了した肺MAC症患者の25%(48/190例)が臨床的な再発をきたしたという報告や11)、48%(74/155例)が培養検査での再発をきたしたという報告12)があります。
- 治療終了後は必ず再発の可能性を念頭におき、3〜6ヵ月おきに定期的な画像経過観察を行い、明らかな悪化を認めたときにはすみやかに治療を再開します1)。
- また、再発のうち75%は再感染であったという報告もあり12)、再感染の予防には注意が必要です13)。
コンサルテーションのタイミング
適切なタイミングで専門医に相談を
- エタンブトールを使用できない場合には、指導医、専門施設にレジメンについての相談を考慮することとされています2)。
- マクロライド耐性の場合、手術適応も含めて専門施設への相談が望まれます2)。
REFERENCES
- 日本結核病学会 編. 非結核性抗酸菌症診療マニュアル. 医学書院; 2015.
- 日本結核・非結核性抗酸菌症学会 非結核性抗酸菌症対策委員会, 日本呼吸器学会 感染症・結核学術部会. 結核. 2023; 98(5): 1-11.
- 中川拓, 小川賢二. 呼吸器ジャーナル. 2018; 66(4): 608-615.
- Daley CL, et al. Clin Infect Dis. 2020; 71(4): e1-e36.
- Koh WJ, et al. Chest.2012; 142(6): 1482-1488.
- Lee G, et al. Ann Am Thorac Soc. 2013; 10(4): 299-306.
- Hwang JA, et al. Eur Respir J. 2017; 49(3): 1600537.
- 日本結核病学会 編. 結核診療ガイド. 南江堂; 2018.
- 厚生労働省. 重篤副作用疾患別対応マニュアル. https://www.mhlw.go.jp/stf/seisakunitsuite/ bunya/kenkou_iryou/iyakuhin/topics/tp061122-1.html(2020年7月2日に利用)
- Moon SM, et al. Antimicrob Agents Chemother. 2016; 60(11): 6758-6765.
- Boyle DP, et al. Ann Am Thorac Soc. 2016; 13(11): 1956-1961.
- Wallace RJ Jr, et al. Chest. 2014; 146(2): 276-282.
- 伊藤穣. 呼吸器ジャーナル. 2018; 66(4): 657-661.